Nature子刊:中国科学家研发出新的新冠黏膜疫苗
时间:2022-10-18
自2020年初以来,全球新冠肺炎大流行已持续2年多。尽管开发了许多COVID-19疫苗,但世界各地的新感染病例仍在周期性地增加。目前市面上的新冠疫苗在降低重症风险方面取得了非常可观的成果,但它们在降低感染概率和病毒传播速度的问题上却显得比较不尽如人意。这是因为这些通过肌内注射的疫苗诱导的抗体在上呼吸道黏膜的含量不够高,无法在病毒侵入时迅速达到免疫效果,而当前在全球大流行的奥密克戎毒株的特性恰恰就是,它们往往聚集在感染上呼吸道:鼻子、喉咙和呼吸道,其实对肺部的伤害比原始毒株要小得多,针对这种情形,黏膜疫苗的研发势在必行。
2022年10月11日,国际著名学术期刊《Cellular & Molecular Immunology》报道了我国多团队合作研发出的一种广谱高效的新冠亚单位滴鼻黏膜疫苗。这项研究的创新之处在于:
1.将多个新冠病毒受体结合域(RBD)整合入一种新型的蛋白骨架之中,构建出了一个可高效诱导局部黏膜免疫的免疫原3Ro-NC。
2.通过肌肉注射小鼠,3Ro-NC展现出不亚于以往疫苗的全身免疫作用。
3.通过滴鼻免疫,3Ro-NC成功诱导了局部黏膜的免疫反应,显著增强了上呼吸道对新冠病毒株的中和活性。

构建拥有广谱表位的新冠免疫原3Ro-NC
SARS-CoV-2病毒表面的刺突蛋白通过受体结合域(RBD)介导病毒的附着和进入,这使其成为COVID-19疫苗设计的潜在靶点。为了克服病毒RBD抗原免疫原性有限的问题并诱导广谱免疫反应,研究人员设计将Delta株和Omicron株的3个RBD结构域嵌入新型的蛋白骨架KFD中,结果发现这种重组蛋白3Ro-NC与四种单克隆抗体的结合能力都很高,并且亲和力明显高于重组前单个的RBD结构域。
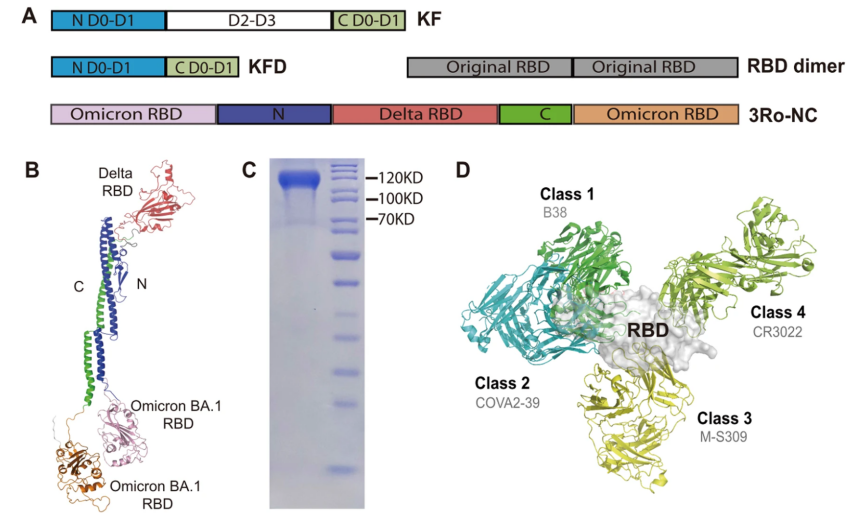
3Ro-NC肌注成功诱导小鼠产生广谱血清IgG抗体
为了分析3Ro-NC的免疫原性,通过BALB/c小鼠肌肉注射,发现3Ro-NC可诱导血清中高滴度的RBD特异性IgG抗体,三次免疫后,3Ro-NC诱导的中和效价高于RBD二聚体诱导的中和效价,产生的中和抗体可高效中和目前所有SARS-CoV-2突变株假病毒,尤其是对最常见的Omicron变种BA.1、BA.2、BA.4和BA.5中和活性更突出。值得注意的是,在第一次免疫后,只有3Ro-NC免疫小鼠对Omicron BA.1和原始菌株产生了显著的中和抗体。
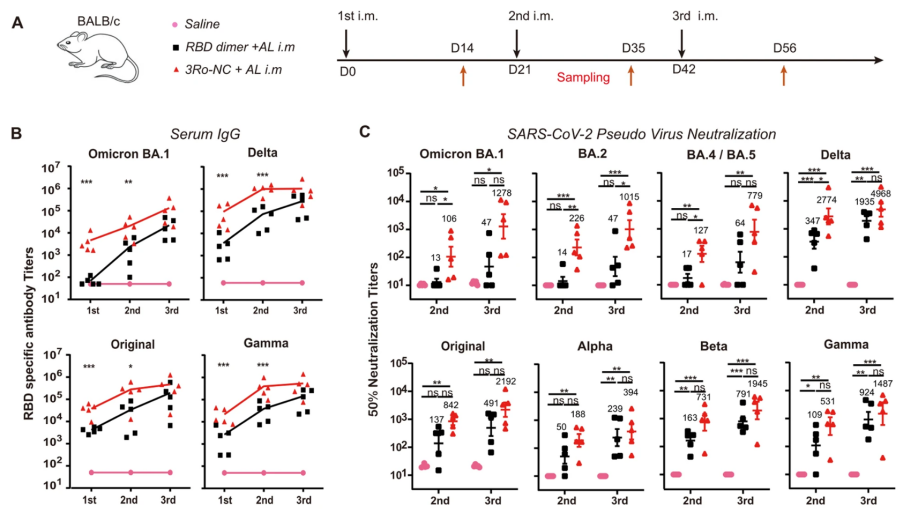
KFD佐剂助力3Ro-NC诱导黏膜免疫应答
黏膜疫苗研发的一个主要障碍是应用于黏膜的抗原通常只能引起相对较弱的免疫应答,为了产生较强的免疫应答,需要强有力的黏膜佐剂和/或递送系统。研究人员选择大肠杆菌鞭毛蛋白衍生的重组蛋白KFD作为黏膜佐剂来检测3Ro-NC作为黏膜免疫原的作用,结果表明相比铝佐剂,3Ro-NC混合KFD三次滴鼻免疫可诱导小鼠产生高滴度的RBD特异的IgG抗体,后者可对不同新冠突变株展现出高效的中和活性。值得注意的是,只有3Ro-NC混合KFD滴鼻免疫接种才能诱导唾液、鼻腔以及阴道灌洗液中均产生有效的IgA抗体应答。
3Ro-NC+KFD免疫显著减少呼吸道黏膜病毒拷贝数
研究者进一步利用人ACE2转基因小鼠(hACE2)评估3Ro-NC+KFD免疫对SARS-CoV-2 Omicron变种BA.1感染的黏膜保护作用,结果发现相比于未免疫对照小鼠,3Ro-NC+KFD免疫小鼠的肺组织中病毒拷贝数降低了85.7倍。同时,通过滴鼻3Ro-NC+KFD免疫接种后,小鼠鼻甲骨组织中的病毒拷贝数降低了13.6倍。安全性方面,研究者同样观察到,相比于灭活疫苗会在肺部诱导明显的炎性细胞浸润,3Ro-NC+KFD免疫小鼠没有明显的肺部炎症。
结论
总的来说,研究人员开发了一个新的嵌合蛋白3Ro-NC,它包含了一个Delta RBD和两个Omicron BA.1 RBD,通过混合重组鞭毛蛋白KFD进行鼻内免疫,可以引起针对不同SARS-CoV-2变种的全身和局部黏膜免疫应答,这使得其成为一种潜在的广谱高效的新冠黏膜疫苗,极具临床应用前景,并为以后的新冠疫苗开发提供了新的思路和方法。
文章链接:https://www.nature.com/articles/s41423-022-00929-3
转自:生命科学前沿

